Exercice 2A
Enoncé :
On dispose d'une solution de sulfate de cuivre de concentration c = 1,00 mol.L-1 avec laquelle on réalise une échelle de teintes et on mesure l'absorbance A pour toutes les solutions réalisées à la longueur d'onde `λ` = 655 nm.
On obtient les résultats suivants :
Solution Dilution Absorbance A a. Calculer les concentrations molaires c en soluté apporté des solutions réalisées pour l'échelle de teintes.
b. Tracer la courbe A = f(c).
c. Une solution de sulfate de cuivre a pour absorbance A = 0,256 à la même longueur d'onde. En déduire sa concentration molaire c en soluté apporté.
Solution :
a) On réalise plusieurs dilution à partir d'une solution-mère de sulfate de cuivre.
Lorsqu'on réalise une dilution 1/N, la concentration cf de la solution-fille est N fois plus petite que celle de la solution-mère cm.
Soit cf = cm/N
La solution-mère ayant une concentration cm = 1,00 mol.L-1, les solutions diluées ont les concentrations molaires données par le tableau suivant :
b) On mesure l'absorbance des solutions de sulfate de cuivre qui ont été préparées.
Remarque : La solutions de sulfate de cuivre ont une couleur "bleu clair" qui est très proche du cyan. Le maximum d'absorbance sera donc obtenu dans le domaine du rouge, d'où le choix de faire les mesures pour une longueur d'onde `λ` = 655 nm.
(Remarque : Pour des raisons pratiques, plutôt que de tracer la courbe sur du papier millimétré , puis de la scanner ..., j'ai choisi de faire la suite de l'exercice en utilisant un tableur).
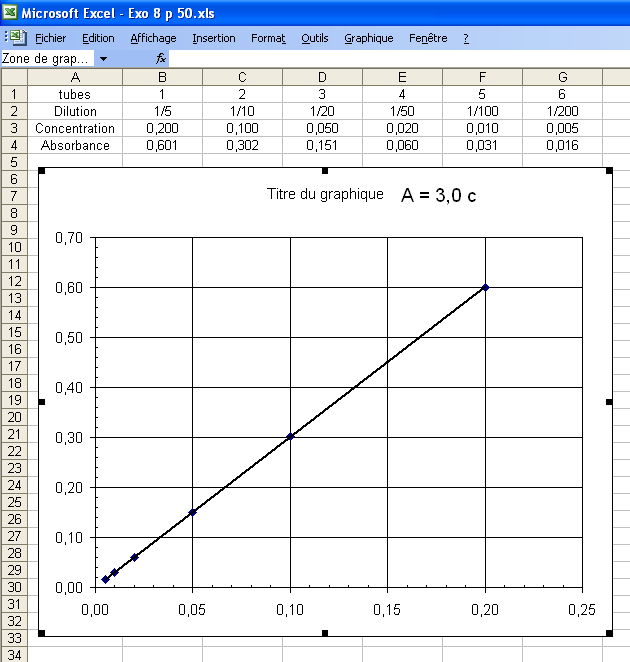
La figure suivante, réalisée avec Excel, donne la position des points de la courbe A655 = f ( c ).
On remarque que les points semblent alignés.
Pour le vérifier, on peut faire tracer la droite passant par les points.
Les points sont effectivement bien alignés !
La droite tracée est en fait la courbe d'étalonnage, A655 = f ( c ) obtenue à la longueur d'onde `λ` = 655 nm.
L'expérience montre que l'absorbance mesurée à cette longueur d'onde est proportionnelle à la concentration de la solution testée. Ceci est tout à fait conforme à la loi vue en cours.
c) La courbe A655 = f ( c ) étant une droite passant par l'origine, pour connaître la concentration d'une solution d'absorbance connue (ici 0,256), on peut :
. . . . . - soit rechercher sur le graphe A655 = f ( c ), l'abscisse du point dont l'ordonnée est égale à 0,256;
. . . . . - soit calculer la concentration connaissant l'équation de la droite.
Si on choisit cette deuxième méthode, on peut faire afficher l'équation de la droite dans Excel.
On obtient l'équation : y = 3,0088 x
Ce qui signifie A = 3,0 c (en gardant 2 chiffres significatifs).
. . . . . . . . D'où : . . .c = `A/(3,0)`
. . . . . . . . A.N. : . . .c = `(0,256)/(3,0)` = 0,085 mol.L-1.
On aurait pu trouver la même valeur en utilisant directement le graphe avec la première méthode.